El monitoreo biológico o biomonitoreo se basa en el uso sistemático de respuestas biológicas de los organismos que habitan el agua para evaluar cambios a nivel ambiental y analizar la calidad del ecosistema. A estos organismos se los denomina indicadores biológicos o bioindicadores de calidad del agua. Los bioindicadores comúnmente utilizados en monitoreos de calidad de agua son: bacterioplancton, fitoplancton, perifiton, macrófitas, macroinvertebrados y peces (Tabla 1). Estos grupos se describen más adelante.
El biomonitoreo puede incluir respuestas a nivel molecular (biomarcadores), el análisis de poblaciones de bioindicadores e índices bióticos que consideran toda la comunidad denominados índices multimétricos. La fuerte modificación antrópica en las cuencas hídricas y la eficiencia de esta metodología hacen que sea actualmente un abordaje muy utilizado.
Tabla 1. Grupos biológicos utilizados como indicadores de calidad del agua.
Bacterioplancton
La importancia de las bacterias en los ecosistemas acuáticos radica en su rol como descomponedoras de la materia orgánica muerta, liberando nutrientes inorgánicos como amonio y dióxido de carbono en la columna de agua. Éstos pueden ser asimilados por productores primarios, como las algas fitoplanctónicas, y de esta manera ingresar nuevamente en las redes tróficas. Además, asimilan la materia orgánica disuelta liberada por el resto de los organismos que componen el plancton y sirven como alimento a predadores pequeños, pudiendo sustentar en parte la base de las redes tróficas (Fortes et al., 2011).
Las bacterias planctónicas constituyen una gran parte de la biomasa de los sistemas acuáticos (Piccini y Conde, 2016). Múltiples factores pueden regular la abundancia y respiración de las bacterias planctónicas. Incrementos en la temperatura, salinidad, pH y disponibilidad de nutrientes favorecen el desarrollo de la biomasa bacterioplanctónica. Por tanto, la abundancia total elevada de estas bacterias puede indicar contaminación por efluentes industriales y urbanos que contribuyen al aumento de estos parámetros fisicoquímicos. Una reducción de la abundancia de bacterias puede estar asociada a la presión de predación por microzoopláncton, infección por virus bacteriófagos o a un descenso de la disponibilidad de los nutrientes limitantes (Piccini y Conde, 2016).
Por lo general, los ríos urbanos presentan una amplia diversidad de bacterias patógenas que tienen el potencial de afectar la salud pública. Algunas de ellas, como Escherichia coli y enterococos suelen ser empleadas en monitoreos de calidad de agua como indicadores de contaminación fecal (Larrea et al., 2013; Kuczynski, 2016).
Fitoplancton
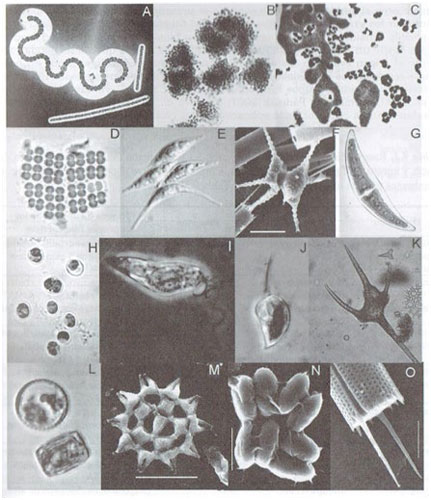
El fitoplancton está constituido por algas y cianobacterias (Figura 1), organismos fotoautótrofos. Los principales factores que estimulan o inhiben su desarrollo son la radiación solar, la temperatura y los nutrientes.
Algunas especies de fitoplancton alcanzan densidades extremadamente altas que se conocen como floraciones o blooms algales que son promovidas generalmente por condiciones de eutrofización. Las floraciones de cianobacterias son las más frecuentes en sistemas dulceacuícolas lénticos (lagos, lagunas) (Figura 2) y las más perjudiciales, ya que múltiples especies producen toxinas, sustancias altamente nocivas para los animales y el ser humano. Al restringir el uso del agua constituyen uno de los problemas más importantes en estos sistemas. En referencia a las floraciones de algas las más comunes son las de clorofitas, diatomeas, euglenofitas y dinoflagelados (Bonilla et al., 2016).
Figura 1. Componentes del fitoplancton en Uruguay. Cianobacterias (A-D). Clorofitas (E-H). Euglenofitas (I). Criptofitas (J). Dinoflagelados (K).
Diatomeas (L). Otras especies de clorofitas (M-N) Otra especie de diatomea (O). Imagen modificada de Arocena, 2016.
Algunas algas, además de alcanzar altas densidades en aguas eutrofizadas, son muy tolerantes a la contaminación orgánica por lo que pueden utilizarse como indicadores de tales condiciones, generadas por contaminación de origen urbano o industrial (Bauer, 2009). Además, ciertas algas como las euglenofitas sufren modificaciones morfológicas que pueden indicar una elevada contaminación de materia orgánica (Padulles et al., 2017).
Figura 2. Floración de cianobacterias en lago de Parque de Miramar, Ciudad de la Costa, Departamento de Canelones. Foto: Luis Aubriot.
Perifiton
El perifiton es el conjunto de organismos adheridos a cualquier sustrato sólido, como rocas o vegetación, sumergidos en el cuerpo de agua. Incluye bacterias, cianobacterias, algas, protozoarios y hongos. Cumple un rol importante en la mineralización de la materia orgánica disuelta, convirtiendo formas inorgánicas en orgánicas y en el ciclo de nutrientes, asimilando nitrógeno y fósforo. Constituye también una fuente de alimento para invertebrados y peces (Wetzel, 2001).
Se destaca por su alta sensibilidad a bajos niveles de ciertas sustancias tóxicas (herbicidas, insecticidas y sustancias radiactivas) y por la fácil obtención de sus muestras y el débil impacto que ésta implica en el ecosistema. Asimismo, muchos organismos del perifiton tienen ciclos de vida cortos que, junto a su modo de vida sésil (fija al sustrato), hacen que respondan rápidamente a las variaciones ambientales (Vera, 2011). Sumado a esto, la elevada riqueza de especies que lo componen le confiere un mayor rango de respuestas a los cambios ambientales. Estas características lo convierten en una herramienta importante de monitoreo.
La biomasa del perifiton, en general, se ve afectada por las actividades antrópicas. Un incremento de los nutrientes disponibles como consecuencia de contaminación agrícola ganadera e industrial promueve el desarrollo del perifiton. En otro sentido, acciones que generan una disminución de la transparencia del agua reduciendo la intensidad de luz que llega al sustrato puede afectar su desarrollo.
Al igual que determinadas especies de macrófitas, el perifiton tiene la capacidad de acumular altas concentraciones de metales pesados como el mercurio (Adriana y Achá, 2016). El estudio de los niveles de metales pesados acumulados en el perifiton es útil para detectar contaminación industrial del agua.
Macrófitas
El conjunto de macrófitas acuáticas incluye a las macroalgas (algas macroscópicas), musgos, helechos y plantas con flor. Se pueden distinguir macrófitas emergentes (enraizadas en el sedimento y que emergen del agua), flotantes (con hojas flotantes en la superficie del agua), sumergidas (que crecen totalmente debajo de la superficie a excepción de sus flores), anfibias (que crecen en ambientes encharcados, casi terrestres) y epífitas (que usan otras macrófitas como sustrato) (Figura 3).
Figura 3. Algunas macrófitas. Izquierda- lenteja de agua (Lemna gibba), flotante (Saxifraga-Rutger Barendse).
Centro: junco, emergente (“Junco (Schoenoplectus californicus)” Licencia, used under CC BY 4.0).
Derecha: cola de zorro acuática (Myriophyllum aquaticum), sumergida (Saxifraga-Willem van Kruijsbergen).
En los lagos la vegetación acuática tiene efectos positivos sobre la calidad del agua. Entre ellos, se destacan el aumento de la transparencia del agua y la generación de una mayor heterogeneidad espacial que favorece la diversidad de peces y aves. Sin embargo, un crecimiento desmedido puede causar un deterioro de la calidad del agua y problemas relacionados a la recreación y navegación (Margalef, 1983).
Las precipitaciones y oscilaciones del nivel del agua condicionan las poblaciones de macrófitas. Algunas especies de plantas acuáticas dominan la comunidad de macrófitas en los períodos de sequía y otras lo hacen luego de las inundaciones. Ciertas plantas, como los juncos, experimentan cambios en su biomasa y en la altura de sus tallos como respuestas a variaciones del nivel del agua (de Assis Esteves, 2011).
Otros factores abióticos que afectan la biomasa y dinámica poblacional de las macrófitas son la forma y tamaño del ecosistema acuático, velocidad del agua, temperatura, radiación (luminosidad) subacuática, nutrientes y carbono inorgánico. Los lugares más expuestos al viento tienen en general una menor densidad de macrófitas, ya que este factor junto con las olas remueve el sedimento y genera un daño físico en las mismas. Incluso, en estas áreas las macrófitas alcanzan profundidades mínimas de colonización mayores que en lugares de vientos moderados para evitar ser arrastradas por las olas (de Assis Esteves, 2011).
La velocidad del agua tiene un efecto acentuado en particular sobre las macrófitas flotantes libres porque éstas no están enraizadas al sustrato. Debido a ello en los sistemas lóticos (ríos y arroyos) en general dominan las especies enraizadas sobre las formas flotantes libres. Las mismas son arrastradas durante grandes inundaciones perdiendo gran cantidad de su biomasa. Las plantas sumergidas también pueden ser afectadas por el flujo del agua (Madsen et al., 2011).
En general, la baja disponibilidad de nutrientes es un factor limitante del desarrollo de los distintos tipos de macrófitas. Además, las plantas sumergidas dependen de la intensidad de la luz en la columna de agua. Variaciones en la densidad de la población de estas plantas pueden asociarse a cambios en la intensidad de luz incidente (Skubinna et al., 1995), por ejemplo por un incremento de la turbidez del agua causado por el aumento de materia orgánica, inorgánica o turbidez por fitoplancton.
El monitoreo de la comunidad de macrófitas acuáticas, ya sea a través de la identificación de determinadas especies o de la evaluación de la densidad de ciertos grupos de macrófitas, es útil para detectar diferencias en la calidad de un ecosistema acuático por contaminación con materia orgánica (Arocena y Mazzeo, 1994; Suárez et al., 2005). En otro sentido, como se mencionó anteriormente, ciertas macrófitas, como Salvinia herzogii (helechito de agua), Lemna minor (lenteja de agua) y Pistia stratiotes (repollito de agua), son tolerantes a la acumulación en sus tejidos algunos metales pesados; por ejemplo de cromo, cadmio, mercurio y plomo (Paris et al., 2005; Arenas et al., 2011; Gomez et al., 2014). Asimismo, algunas especies pueden acumular pesticidas (Pérez et al., 2017). El monitoreo de esta acumulación en plantas acuáticas permite identificar condiciones de contaminación de los sistemas acuáticos por metales pesados y pesticidas que puede ser causada por el vertido de efluentes industriales e ingreso difuso por escorrentía en ciudades y sistemas agroindustriales.
Macroinvertebrados
Los macroinvertebrados son organismos invertebrados de tamaño superior a 0,5 mm. Entre ellos se pueden distinguir moluscos, crustáceos, anélidos y larvas de insectos. Representan una gran variedad de grupos funcionales. Son la conexión entre los productores primarios y los grupos tróficos superiores.
En base a su dieta, se los puede clasificar como trituradores de materia orgánica particulada gruesa (MOPG), raspadores de perifiton, detritívoros que consumen MOPG y perifiton, recolectores de materia orgánica particulada fina (MOPF), filtradores de MOPF y depredadores de otros invertebrados (Tomanova et al., 2006). Debido a que son sumamente relevantes en los procesos de fragmentación y descomposición de la materia orgánica, las actividades humanas que generan un deterioro ambiental, afectando la comunidad de macroinvertebrados, pueden tener un efecto importante en la velocidad de dichos procesos. En este sentido, estudios de la descomposición de hojarascas por macroinvertebrados acuáticos pueden evidenciar el deterioro de la calidad del agua cuando se registran velocidades muy bajas de descomposición (Rincón et al., 2017).
La gran diversidad de grupos funcionales, tamaños, hábitats y niveles de tolerancia a diferentes tipos de contaminación ha hecho que sea un grupo ampliamente utilizado en programas de biomonitoreo. El registro por observación y estimación de abundancia de especies sensibles o tolerantes a un determinado tipo de contaminación permite interpretar el grado de impacto sobre el ambiente. Su recolección (Figura 4) resulta sencilla debido a su escaso movimiento y puede realizarse, al igual que su análisis, con equipos de bajo costo en poco tiempo (Rosenberg et al., 1993). Sin embargo, los macroinvertebrados presentan algunas dificultades al momento de su uso como bioindicadores relacionados a su clasificación taxonómica, aunque actualmente la mayoría de los trabajos se basan en el análisis a nivel de familias lo que facilita su clasificación. Las variaciones en las poblaciones de determinadas familias de macroinvertebrados pueden reflejar de forma muy buena la calidad del agua (Roldán, 1999).
Figura 4. Colecta de macroinvertebrados con red de mano. Foto: Núcleo Aguas Urbanas.
La distribución de los distintos macroinvertebrados depende de las condiciones ambientales y distribución de recursos. Frecuentemente, las comunidades que se encuentran en sistemas contaminados con materia orgánica están dominadas por oligoquetos (grupo que incluye a las lombrices y gusanos acuáticos) y larvas de quironómidos (grupo de insectos). Cabe señalar que estos últimos también pueden ser encontrados en aguas oxigenadas, no contaminadas. Ambos grupos suelen ser utilizados como indicadores de mala calidad del agua (DeShon, 1995).
Algunos macroinvertebrados son moderadamente tolerantes a la contaminación orgánica, como los gasterópodos (caracoles y babosas entre otros) y ninfas, estados inmaduros, de odonatos (grupo de insectos que incluye a las libélulas). Aquellos sensibles a la carga de materia orgánica se representan principalmente por bivalvos (almejas y mejillones) y ninfas de efemerópteros y de plecópteros, dos grupos de insectos. Los efemerópteros, plecópteros y tricópteros son clásicos insectos representantes de buena calidad del agua. Se agrupan en un índice denominado EPT, que representa la abundancia de estos tres grupos en la abundancia total de una muestra (EPA, 2003).
Peces
Los peces son considerados buenos indicadores biológicos y utilizados a nivel mundial dado que presentan alta sensibilidad a las presiones antrópicas como la contaminación química, la eutrofización, la acidificación y modificación de hábitats. Cambios en la composición y densidad de la comunidad de peces pueden reflejar los efectos nocivos de vertidos de contaminación puntual y difusa.
Habitan prácticamente todos los ecosistemas acuáticos, incluyen representantes de múltiples grupos tróficos con una amplia variedad de tamaños, ciclos de vida y modos de reproducción y reflejan cambios en el ambiente acuático de una escala espacial y temporal grande en relación con otros bioindicadores como el perifiton y macroinvertebrados. Su colecta e identificación es fácil en relación con las de otros grupos de bioindicadores y pueden ser analizados en el lugar de muestreo para su posterior liberación (Karr, 1981). Además, permiten trabajar a diferentes niveles de complejidad biológica desde el nivel molecular al de comunidad.
La abundancia de las distintas especies puede estimarse por captura, utilizando artes de pesca como espineles, trasmallos, redes de enmalle, trampas, redes de arrastre, o por medio de pesca eléctrica. Su uso como bioindicadores, al igual que los macroinvertebrados, consiste en asociar especies a sistemas con diferente grado de impacto por contaminación. Por ejemplo, algunas especies como Cnesterodon decemmaculatus, comúnmente llamada madrecita, son muy resistentes a contaminación por lo que se usan como indicadores de tal condición (Teixeira de Mello et al., 2011; Benejam et al., 2016).